杏鑫王陈继副研究员和同济大学附属第一妇婴保健院高昆研究员、万小平教授合作,于2022年12月9日在Cell Death & Differentiation杂志在线发表了题为“SPOP Mutations Promote Tumor Immune Escape in Endometrial Cancer via the IRF1–PD-L1 Axis ”的最新研究成果💇🏿。
程序性细胞死亡受体1(PD-1)是一种重要的免疫抑制分子🍽,为CD28超家族成员🤹🏼♀️。以PD-1为靶点的免疫调节在抗肿瘤、抗感染🥶、抗自身免疫性疾病及器官移植存活等方面均有重要意义。正常情况下免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应☹️,促进具有抗原特异性的T细胞增生。程序性细胞死亡1配体(PD- L1)与PD-1结合💚,可以传导抑制性的信号,减低T细胞的增殖🤦🏼♂️。肿瘤细胞逃避T细胞摧毁的一种途径是通过在它表面异常表达PD-L1识别PD-1后👩🏽🌾,传导抑制性信号,T细胞就不能发现肿瘤细胞和向肿瘤细胞发出攻击信号⬆️。PD-1/PD-L1阻断已发展成为癌症患者最有前途的免疫治疗策略之一🐥,阻止PD-1和PD-L1的识别过程🤍,部分恢复T细胞功能😟,从而使T细胞可以杀死肿瘤细胞🧙🏼♀️。然而💿,导致肿瘤细胞中PD-L1异常过表达的遗传变异机制改变仍然知之甚少。
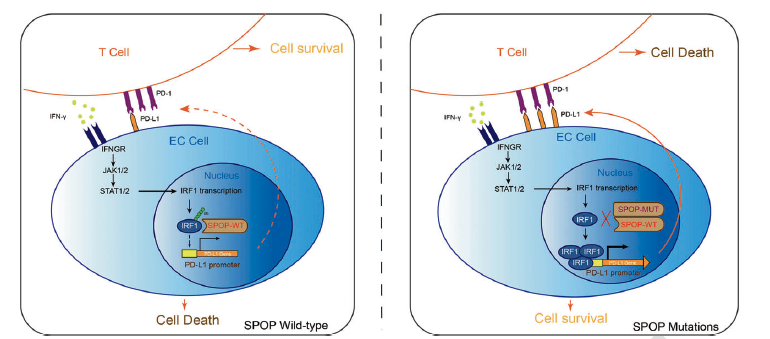
在内膜癌中,编码Cullin 3 E3泛素连接酶复合体底物识别亚基的SPOP基因存在高频突变(6-10%),但其突变导致内膜癌发生发展的分子机制仍不完全清楚。在本项研究中,该团队报道了SPOP可以在转录水平负向调节PD-L1。野生型SPOP结合IRF1,随后介导其泛素-蛋白酶体途径降解。由于IRF1是诱导PD-L1表达的主要转录因子,因此野生型SPOP可以抑制IRF1介导的PD-L1转录上调⚡️。相比之下,内膜癌来源的SPOP突变体失去了降解IRF1的能力、进一步上调了了IRF1和PD-L1表达🧎➡️。同时🍿,内膜癌来源的SPOP突变体通过增加IRF1和PD-L1的表达来促进小鼠移植瘤的生长,且该促进作用可以被抗PD-L1单抗治疗所逆转🪡。
本研究确定了SPOP作为IRF1-PD-L1轴的负调控因子👞,并描述了IRF1和PD-L1在SPOP突变驱动的内膜癌免疫逃避中的关键作用💆🏻♂️。另外✊🏻🧍🏻♀️,检测SPOP突变状态可能有助于识别对PD-1/PD-L1阻断免疫治疗有响应的内膜癌病人群体。
同济大学附属第一妇婴保健院的高昆研究员、杏鑫史晴博士后、同济大学附属第一妇婴保健院顾烨博士为该论文的共同第一作者👲。王陈继副研究员👩🏻⚕️、高昆研究员和万小平教授为该论文的共同通讯作者⏲。
原文链接💑👩🏽🍳:https://www.nature.com/articles/s41418-022-01097-7

